-
-
-
Tổng tiền thanh toán:
-

Tổng hợp kiến thức Hóa học lớp 10 thường xuất hiện trong các bài thi
18/05/2021 Đăng bởi: Công ty cổ phần CCGroup toàn cầu
Tổng hợp kiến thức Hóa học lớp 10 là một bước quan trọng mà học sinh lớp 11 hay lớp 12 cần thực hiện. Với học sinh lớp 11, các em sẽ hệ thống lại được những kiến thức cũ để dễ dàng tiếp thu kiến thức của năm học mới. Đối với những em lớp 12, phần tổng hợp kiến thức trọng tâm sẽ giúp các em chuẩn bị cho kì thi THPT Quốc gia một cách hoàn hảo nhất.

Các kiến thức hóa học trọng tâm của lớp 10
Tổng hợp kiến thức Hóa học lớp 10 phần lý thuyết
Trong phần Hóa học vô cơ ở lớp 10, CCBook sẽ nhắc lại những kiến thức quan trọng nhất. Các kiến thức thường xuất hiện trong các đề thi.
Nguyên tử
Nguyên tử là phần kiến thức hóa học cơ bản nhất mà học sinh cần ghi nhớ. Đây chính là nền tảng để các em tiếp thu các bài học ở lớp 11 và lớp 12 được tốt hơn.
Thành phần cấu tạo của nguyên tử:
Bao gồm hạt nhân và vỏ hạt nhân.
Hạt nhân có chữa điện tích dương P và Hạt Nơtron không mang điện.
Vỏ hạt nhân là những electron mang điện tích âm.
m= 1,6726.10-27kg
q= + 1,602.10 -19C
| Electron | Prontron | Nơtron |
me = 9,1094.10 -31 kg qe = -1,602.10-19 C | m= 1,6726.10-27kg q= + 1,602.10 -19C | Hạt không mang điện. Khối lượng gần bằng khối lượng của Proton |
Số khối A là tổng số hạt Proton và Nơtron. A= Z+N
Số hiệu nguyên tử: Số đơn vị điện tích hạt nhân của 1 nguyên tố
Đồng vị: Các nguyên tố hóa học có nguyên tử có cùng số Pronton nhưng khác nhau về số Nơtron.
Các đồng vị có số khối khác nhau nhưng tính chất hóa học giống nhau.
Cấu hình electron nguyên tử
Lớp electron
Khi nguyên tử ở trạng thái cơ bản, các e sẽ chiếm các mức năng lượng từ thấp đến cao và xếp thành từng lớp. Trên cùng một lớp các e có mức năng lượng gần bằng nhau.
Các phân lớp e được ký hiệu: s,p,d,f
Bảng tuần hoàn nguyên tố hóa học
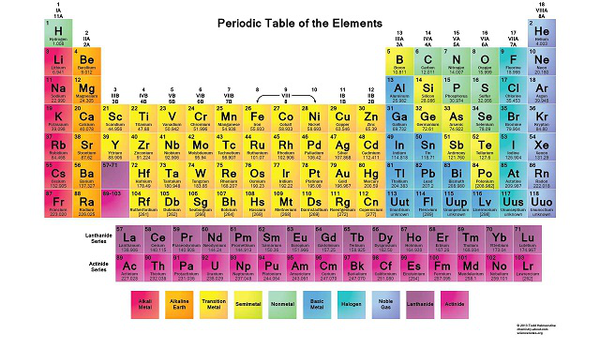
bảng tuần hoàn nguyên tố hóa học
Cấu tạo của bảng tuần hoàn
Trong bảng tuần hoàn các nguyên tố sắp xếp theo chiều tăng dần điện tích hạt nhân.
Các nguyên tố cũng số lớp e xếp thành 1 hàng
Các nguyên tố có cùng số e hóa trị xếp thành 1 cột.
Thành phần của bảng tuần hoàn nguyên tố hóa học
Trong bảng tuần hoàn sẽ có ô, chu kì và nhóm. Trong đó:
Ô: Mỗi nguyên tố được xếp vào một ô
Chu kì: Là các dãy nguyên tớ mà nguyên tử của chúng có cùng số lớp e
Nhóm: Tập hợp các nguyên tố mà nguyên tử có cấu hình e tương tự nhau. Nhóm A gồm các nguyên tố s, p. Nhóm B gồm các nguyên tố d,f.
Vị trí của nguyên tố trong bảng tuần hoàn
Ô số= số thứ tự nguyên tố =Z=P=E
Chu kì= số lớp e
Nhóm= số e hóa trị
Định luật tuần hoàn
- Tính kim loại- phi kim
Trong cùng một chu kỳ khi điện tích hạt nhân tăng thì tính kim loại giảm, tính phi kim tăng
Trong cùng một nhóm A, khi điện tích hạt nhân tăng thì tính kim loại tăng, tính phi kim giảm.
- Sự biến đổi hóa trị: Nguyên tố M thuộc nhóm xA
Công thức oxit cao nhất M2Ox ( x chạy từ 1 đến 7)
Công thức hợp chất khí với Hiđro là MH8-x ( X chạy từ 4 đến 7).
- Sự biến đổi tính axit- bazơ
Trong 1 chu kì, khi Z tăng thì tính bazơ giảm, tính axit tăng
Liên kết hóa học
Liên kết hóa học là kiến thức quan trọng cần phải nhớ
Khi tổng hợp kiến thức hóa Học lớp 10 học sinh cần đặc biệt chú ý đến phần liên kết hóa học. Bởi vì nếu không nắm chắc phần kiến thức này, các em sẽ khó tiếp thu được những bài mới của lớp 11 hay 12.
Liên kết hóa học là sự kết hợp giữa các nguyên tử thành phân tử hay tinh thể bền vững.
| Loại liên kết | Liên kết ion | Liên két cộng hóa trị | |
| Không cực | Có cực | ||
| Định nghĩa | Là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu. | Là liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung. | |
| Đản chất của liên kết | Electron chuyển từ nguyên từ này sang nguyên tử kia. | Đôi electron chung không lệch về nguyên tử nào. | Đôi electron chung lệch về nguyên từ có độ âm điện lớn hơn. |
| Hình thành | Kim loại và phi kim điển hình | Nguyên tố có tính chất giống/gần giống nhau | |
| Ví dụ | NaCI, MgO, BaS04,... | H2, Cl2, O2,... | H2O, NH3, HCI,… |
Ngoài những liên kết hóa học trên, chúng ta cũng cần phải nhớ: Liên kết kim loại, liên kết Hiđro.
Xem thêm: Tổng hợp kiến thức Hóa học lớp 10 phần phản ứng hóa học
Tổng hợp kiến thức Hóa học lớp 10 phần bài tập
Sau khi đã tổng hợp kiến thức Hóa học lớp 10 phần lý thuyết trọng tâm nhất, CCBook sẽ giúp các em tiếp tục hệ thống lại phần bài tập.
Dưới đây là những dạng bài tập quen thuộc mà chắc chắn học sinh sẽ gặp khi làm bài kiểm tra, bài thi.
- Dạng 1: Cấu tạo nguyên tử đồng vị
- Dạng 2: Cấu hình eletron
- Dạng 3: Vị trí nguyên tố trong bảng tuần hoàn và định luật tuần hoàn
- Dạng 4: Xác định nguyên tố hóa học
- Dạng 5: Liên kết hóa học và cấu trúc mạng tinh thể
Với mỗi dạng bài tập trên, các em cần thực hành làm bài tập thật nhiều để hiểu sâu bản chất vấn đề, rút ra phương pháp giải nhanh, kinh nghiệm khi gặp dạng bài tương tự.
Cuốn sách giúp tổng hợp kiến thức Hóa học lớp 10 cả lý thuyết lẫn bài tập bài bản nhất

Sách Đột phá 8+ kì thi THPT Quốc gia môn Hóa học
Đột phá 8+ kì thi THPT Quốc gia môn Hóa học là cuốn sách tổng hợp kiến thức của cả 3 năm cấp III. Trong đó kiến thức Hóa học lớp 10 được cô đọng giúp các em tiết kiệm được thời gian khi ôn tập. Bên cạnh đó sách cũng đưa ra những dạng bài tập chi tiết kèm theo ví dụ minh họa. Các ví dụ giải bài rất chi tiết, lồng ghép với phương pháp giải nhanh nâng cao tối đa hiệu quả học tập cho học sinh.
Các em học lớp 11 hay lớp 12 đều có thể tự học, tự làm bài tập để tổng hợp kiến thức Hóa học lớp 10.
Ngoài phần kiến thức được hệ thống lại bài bản, sách Đột phá 8+ kì thi THPT Quốc gia môn Hóa còn kèm theo tiện ích video bài giảng, hệ thống thi thử CCTest, và nhóm giải đáp học tập trên facebook. Những tiện tích đi kèm này sẽ tối đa hóa hiệu quả học tập của học sinh. Cuốn sách sẽ là hành trang giúp các em đạt kết quả tốt trong 3 năm học nếu các em chăm chỉ, khai thác sách đúng hướng.
Xem thêm: Các kiến thức hóa học 10 trọng tâm nhất
Mới! CC Thần tốc luyện đề 2022 giải pháp giúp sĩ tử TĂNG ĐIỂM CHẮC CHẮN TRONG THỜI GIAN NGẮN (12/01/2022)
Đột phá 8+ phiên bản mới nhất có gì khác biệt so với phiên bản cũ? (21/08/2021)
Giới thiệu bộ sách Đột phá 8+ phiên bản mới dành riêng cho 2K4 (03/08/2021)
Đề thi và đáp án đề thi THPT Quốc gia 2021 môn GDCD (08/07/2021)
